Das gescheiterte Alzheimer-Medikament kann die CAR-T-Zelltherapie bei multiplem Myelom verstärken
Die relativ neue Art der Krebsbehandlung, die als CAR-T-Zelltherapie bekannt ist, wird bereits zur Behandlung einiger Menschen mit Leukämie und Lymphomen eingesetzt. Diese Form der Immuntherapie hat sich auch als vielversprechend für die Behandlung des multiplen Myeloms erwiesen , obwohl sie von der Food and Drug Administration (FDA) noch nicht für diese Anwendung zugelassen ist.
Obwohl eine solche Zulassung möglicherweise nicht in greifbarer Nähe liegt, deuten die Ergebnisse einer neuen Studie bereits auf einen möglichen Weg hin , um die Wirksamkeit der CAR-T-Zelltherapie bei multiplem Myelom zu verbessern . Der Ansatz, der von einem Forscherteam des Fred Hutchinson Cancer Research Center in Seattle angeführt wird, basiert auf einer Klasse von Arzneimitteln, die Gamma-Sekretase-Inhibitoren (GSIs) genannt werden. Einige dieser Medikamente wurden zur Behandlung der Alzheimer-Krankheit untersucht, sind jedoch für diese Anwendung nie vorgesehen.
CAR T-Zellen sind so konstruiert, dass sie einen Rezeptor produzieren , der an einem bestimmten Protein auf der Oberfläche von Krebszellen ankommt. Beispielsweise zielen die beiden von der FDA zugelassenen CAR-T-Zelltherapien – Tisagenlecleucel (Kymriah) und Axicabtagene Ciloleucel (Yescarta) – beide auf das CD19-Protein.
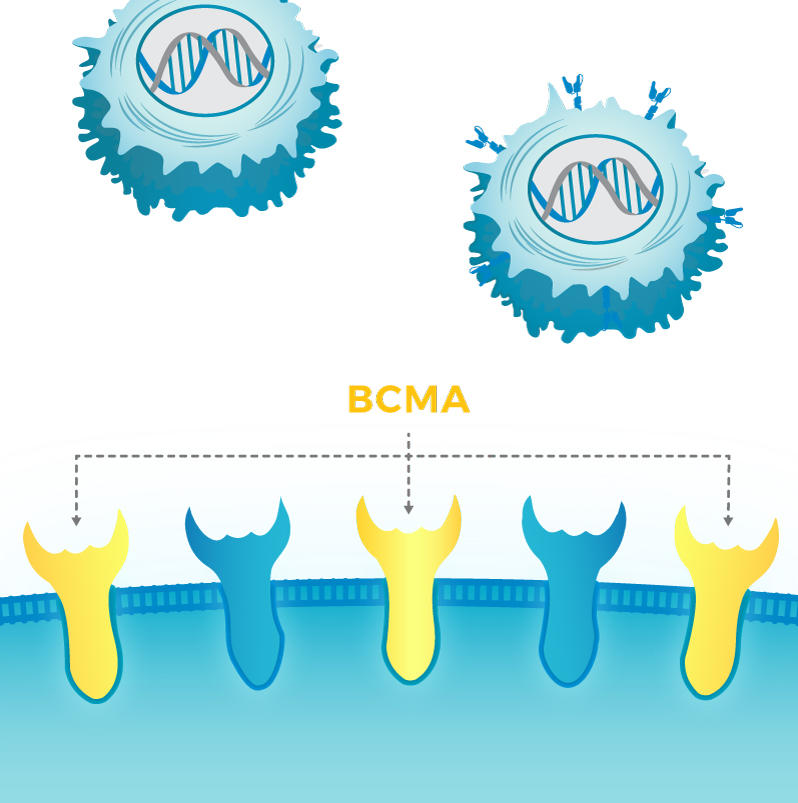
Bei multiplem Myelom wurde die CAR-T-Zelltherapie kurz vor der FDA-Zulassung entwickelt, um auf ein Protein namens BCMA abzuzielen. In der neuen Studie, die am 27. September in Blood veröffentlicht wurde , zeigten die Forscher, dass die Behandlung von Myelomzellen mit einem GSI die Menge an BCMA erhöhte, die sie auf ihrer Oberfläche produzierten.
Und wenn Mäuse mit Myelomtumoren sowohl mit GSI- als auch mit BCMA-Ziel-CAR-T-Zellen behandelt wurden, reagierte der Krebs viel empfindlicher auf die Behandlung als bei Mäusen, denen CAR-T-Zellen allein verabreicht wurden, und die Mäuse lebten über lange Zeiträume. Im Gegensatz dazu reagierten Mäuse, die nur die CAR-T-Zellen erhielten, zunächst auf die Behandlung, aber ihr Krebs kehrte schließlich zurück und tötete sie.
Die Ergebnisse, so die leitende Forscherin der Studie, Margot Pont, Ph.D., legen nahe, dass "wenn Sie mehr Myelomzellen zur Expression von [BCMA] bringen können, diese von den CAR-T-Zellen effizienter erkannt werden können."
Verbesserung der Antigendichte
BCMA wird häufig in Plasmazellen, der Ursprungszelle des multiplen Myeloms, und häufig in höheren Konzentrationen in Tumorzellen bei Patienten mit diesem Krebs gefunden.
In klinischen Studien sprechen viele Menschen mit multiplem Myelom, die mit BCMA-CAR-T-Zellen behandelt wurden, zunächst auf die Behandlung an, wobei bei einigen Patienten keine messbaren Spuren des Krebses zurückblieben. Bei den meisten Menschen tritt der Krebs jedoch in der Regel innerhalb von 6 bis 12 Monaten wieder auf.
Es gibt Hinweise darauf, dass Myelomzellen durch das Abstreifen von BCMA nicht von CAR-T-Zellen angegriffen werden können, erklärte Dr. Jesus Berdeja vom Sarah Cannon Research Institute in Tennessee, der an mehreren Studien zur BCMA-CAR-T-Zelltherapie beteiligt war.
"Der Verlust des BCMA-Antigens scheint einer der Mechanismen der Resistenz gegen die CAR-T-Zelltherapie zu sein", sagte Dr. Berdeja. Der Antigenverlust als Ursache für die Therapieresistenz scheint jedoch ein größeres Problem bei CD19-CAR-T-Zelltherapien zu sein.
Eine weitere potenzielle Hürde für CAR-T-Zellen besteht darin, dass Teile des freigesetzten Zielantigens im Blutkreislauf verbleiben, als Täuschkörper fungieren und CAR-T-Zellen abziehen, die ansonsten Tumorzellen angreifen könnten. Es ist unklar, wie bedeutend dieses Problem bei der BCMA-CAR-T-Zelltherapie sein könnte, bemerkte Dr. Berdeja.
Das Forschungsteam von Fred Hutchinson hatte nach Wegen gesucht, die Funktionsweise von BCMA CAR T-Zellen zu verbessern, und dabei nach Wegen gesucht, um die BCMA-Menge auf Myelomzellen, die als Antigendichte bekannt ist, zu erhöhen, sagte Dr. Pont. Das führte sie zum Enzym Gamma-Sekretase, mit dem sich die Zellen von BCMA von ihrer Oberfläche befreien.
Gamma-Sekretase ist auch an der Produktion der Amyloid-Proteine durch Gehirnzellen beteiligt, von denen angenommen wird, dass sie die Entwicklung und das Fortschreiten von Alzheimer vorantreiben. Diese Rolle veranlasste die Forscher zunächst, Medikamente zu entwickeln, die die Aktivität der Gamma-Sekretase blockieren.
Einer der leitenden Autoren der neuen Studie, Dr. Damian Green, fragte sich, ob die Blockierung der Aktivität der Gamma-Sekretase die Wirksamkeit von Behandlungen gegen BCMA auf Myelomzellen verbessern könnte. "Die Gamma-Sekretase ist dafür verantwortlich, dass BCMA die ganze Zeit über von Plasmazellen abgespalten wird", sagte Dr. Pont. "Wir haben untersucht, ob die Blockierung der Gamma-Sekretase ein guter Ansatz ist, um das Ziel auf der Tumorzelloberfläche zu erhöhen."
Erfreuliche Ergebnisse bei Mäusen
In einer Reihe von Experimenten zeigten die Forscher, dass die Behandlung von Myelomzellen mit einem GSI sowohl in Zelllinien als auch in solchen, die aus dem Knochenmark von Patienten entnommen wurden, die Menge an BCMA, die die Zellen exprimierten, dramatisch erhöhte. Sie stellten wiederum fest, dass dieser erhöhte BCMA-Spiegel die Bindung von CAR-T-Zellen an Myelomzellen verbesserte.
Als die Forscher zu Mäusen wechselten, stimmten die Ergebnisse mit den Erwartungen ihrer früheren Experimente überein. Zum Beispiel erhöhte die GSI-Behandlung die BCMA-Expression in Tumorzellen der Mäuse. Bei zwei verschiedenen Mausmodellen war es weitaus wahrscheinlicher, dass sich der Krebs bei Mäusen, die die GSI-CAR-T-Zellkombination erhielten, über einen längeren Zeitraum zurückbildete und die Lebensdauer der Mäuse verbesserte, verglichen mit der CAR-T-Zelltherapie allein.
Eine Sorge, stellte Dr. Pont fest, war, ob die GSI-Behandlung die Fähigkeit von CAR-T-Zellen, Krebszellen abzutöten, beeinträchtigen könnte. Das liegt daran, dass die Gamma-Sekretase auch mit einem Protein namens Notch interagiert, das eine wichtige Rolle für die ordnungsgemäße Funktion von T-Zellen spielt.
Tatsächlich fanden sie in Laborstudien Hinweise darauf, dass GSIs die Aktivität von T-Zellen beeinträchtigen könnten. Es trat jedoch nur dann auf, wenn die Arzneimittel in sehr hohen Dosen verabreicht wurden, viel höher als in den Mausexperimenten.
Dennoch schrieben Dr. Pont und ihre Kollegen, dass die Dosierung eines GSI bei Patienten, die mit BCMA-CAR-T-Zellen behandelt werden, möglicherweise angepasst werden muss, „um nachteilige Auswirkungen auf die CAR-T-Zell-Funktion zu vermeiden“.
Erste Erfahrungen beim Menschen
Dr. Pont und ihre Kollegen berichteten auch über einige Ergebnisse von drei Personen mit fortgeschrittenem multiplem Myelom, die zur Teilnahme an einer kleinen klinischen Phase-1-Studie berechtigt waren , um die Sicherheit des Kombinationsansatzes zu testen .
Die Patienten – Teil einer kleinen „Einlaufgruppe“, die zur Bewertung der Wirkung von GSI unabhängig von der CAR-T-Zelltherapie herangezogen wurde – erhielten über 5 Tage drei Dosen eines GSI. Die Behandlung verdreifachte nahezu den Prozentsatz der Myelomzellen mit messbarer BCMA-Expression und erhöhte die Expression in Myelomzellen im Median um das 33-fache.
Die in der Studie verwendeten Gründe und Ansätze zur Erhöhung der Antigendichte „sind gut und definitiv eine Fortsetzung wert“, sagte Dr. Berdeja.
Im Rahmen dieser Studie, so Dr. Pont, erhofft sich das Forscherteam weitere Informationen darüber, wie Myelomzellen der CAR-T-Zelltherapie widerstehen. Sie werden auch sorgfältig die Wirkung der GSI auf T-Zellen untersuchen, sagte sie, "insbesondere im Knochenmark."
Quelle: National Cancer Institute