NCI-Initiative zielt darauf ab, klinische Studien zur CAR-T-Zelltherapie zu fördern
Im Jahr 2010 veröffentlichte ein NCI-Forschungsteam die erste Studie über eine neue Form der Krebsbehandlung namens CAR-T-Zelltherapie, in der über einen einzelnen Patienten mit fortgeschrittenem Lymphom berichtet wurde, dessen Krankheit nach der Behandlung „eine dramatische Regression durchlief“ . Im nächsten Jahr berichteten Forscher der University of Pennsylvania über ein ähnliches Ergebnis bei der Verwendung der CAR-T-Zelltherapie zur Behandlung eines Patienten mit einer fortgeschrittenen Form von Leukämie .
Innerhalb von 7 Jahren genehmigte die Food and Drug Administration (FDA) die ersten beiden CAR-T-Zelltherapien . Mit einer dritten Zulassung, die noch in diesem Jahr erwartet wird, entwickeln Forschungsgruppen auf der ganzen Welt rasch neue CAR-T-Zelltherapien .
Diese Krebsbehandlungen haben wie kaum ein anderer die Aufmerksamkeit der Öffentlichkeit und die Vorstellungskraft der Forscher auf sich gezogen. Dies liegt zum Teil an der bemerkenswerten Art und Weise, wie sie bei einigen Menschen mit fortgeschrittenem Blutkrebs Krebs beseitigen können. Es liegt auch daran, woher sie kommen: das eigene Blut eines Patienten. Komponenten dieses Blutes werden dann verwendet, um die Behandlung zu erstellen.
Die Umwandlung dieser Komponenten in die Therapie, die schließlich an den Patienten zurückgegeben wird, erfordert einen hochkomplexen Herstellungsprozess. Und das ist ein Teil dessen, was die CAR-T-Zelltherapie von den meisten anderen Krebsbehandlungen unterscheidet, erklärte Anthony Welch, Ph.D., Projektleiter in der Abteilung für Krebsbehandlung und -diagnose (DCTD) von NCI.
"Bei CAR T-Zellen ist der Prozess das Produkt", sagte Dr. Welch. Dieser Prozess ist auch teuer, kompliziert und stark reguliert.
Dies ist ein Teil dessen, was die Durchführung klinischer Studien am Menschen, in denen diese individualisierten CAR-T-Zelltherapien getestet werden, schwieriger macht als die Durchführung von „Standard“ -Medikamenten, die in großen Mengen hergestellt werden. Nur wenige Labors und Zentren sind in der Lage, CAR-T-Zellen herzustellen, was die Fähigkeit, sie umfassender zu testen, eingeschränkt hat.
Um diesen Herausforderungen zu begegnen, wandten sich die Verantwortlichen von DCTD und NCI vor mehr als einem Jahr an ihre Experten im Frederick National Lab für Krebsforschung (FNLCR) und beauftragten sie mit der Entwicklung der Fähigkeit, Zelltherapien wie CAR-T-Zellen für Krebs herzustellen. Insbesondere bestand das Ziel darin, die Möglichkeit zu beschleunigen, diese Therapien in klinischen Studien zu testen, die an mehreren Krankenhausstandorten durchgeführt werden sollen.
Die erste klinische Studie, die durch diese Bemühungen unterstützt wird, wird die erste Studie sein, in der eine CAR-T-Zelltherapie getestet wurde, die auf ein Protein gegen Krebszellen namens CD33 bei Kindern und jungen Erwachsenen mit fortgeschrittenen Formen der akuten myeloischen Leukämie (AML) abzielt . Letztendlich werden Patienten an sechs verschiedenen Standorten aufgenommen, beginnend am NIH Clinical Center in Bethesda, MD, und am Kinderkrankenhaus in Philadelphia (CHOP).
Mehrere Standorte für die erste Studie zu haben, ist sowohl für die Prüfer als auch für die Patienten von Vorteil, sagte der Co-Lead-Prüfer der Studie, Richard Aplenc, MD, von CHOP, wo der erste Patient in der Studie im Januar aufgenommen wurde.
"Es wird den Zugang zu dieser Untersuchungstherapie wirklich erweitern", fuhr Dr. Aplenc fort. "Wir haben Standorte an beiden Küsten und mitten im Land."
Und da die Forscher versuchen, die CAR-T-Zelltherapie als Option für andere Krebsarten, einschließlich solider Tumoren , auszuweiten, wird es laut Dr. Welch entscheidend sein, die Hindernisse für ihren Erfolg abzubauen.
"Das ist die Idee, die wir unterstützen wollen", sagte er. "Wir nehmen einen Teil des Risikos aus der Entwicklung innovativer Konzepte und Ideen, indem wir dazu beitragen, mehr dieser Therapien in frühe klinische Studien einzubeziehen."
Von einer Blutentnahme zu einer technischen Zelltherapie
Kurz gesagt, die Herstellung einer CAR-T-Zelltherapie funktioniert so.
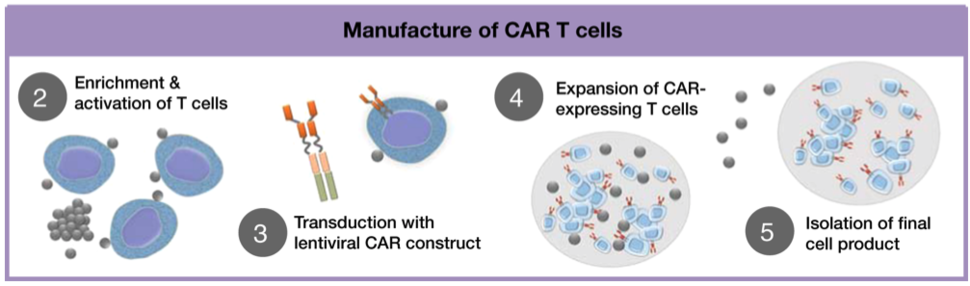
Zuerst wird das eigene Blut eines Patienten gesammelt und die weißen Blutkörperchen aus dieser Sammlung werden abgetrennt, wobei die verbleibenden roten Blutkörperchen und das Plasma an den Patienten zurückgegeben werden, ein Prozess, der als Leukapherese bekannt ist .
Sobald die gesammelten weißen Blutkörperchen vorliegen, verwenden Forschungsgruppen verschiedene Methoden, um bestimmte T-Zellen von den anderen weißen Blutkörperchen zu isolieren. Dann wird ein entwaffnetes Virus verwendet, um den T-Zellen genetische Anweisungen zu geben, die sie auffordern , den chimären Antigenrezeptor (CAR), der auf ihren Oberflächen landet, und co-stimulierende Moleküle, die sich in der Zelle befinden, zu produzieren. (Durch die Abgabe von Signalen, die die T-Zellen aktiv halten, helfen die co-stimulierenden Moleküle den CAR-T-Zellen zu überleben und zu wachsen, sobald sie wieder in den Patienten eingeführt werden.)
Als nächstes wird diese kleine Charge von CAR-T-Zellen dazu gebracht, sich zu vermehren, bis sie sich in Millionenhöhe befinden. Dieser Prozess wird sorgfältig überwacht, um sicherzustellen, dass ihre Anzahl ausreicht, um die geeignete „Dosis“ von T-Zellen zu erreichen.
Der letzte Schritt auf dem Weg zur Herstellung erfordert eine wichtige Reinigung, um die Reinheit und Qualität der CAR-T-Zellen sicherzustellen. Zu diesem Zeitpunkt können sie wieder in den Patienten infundiert werden.
Derzeit kann nur eine kleine Gruppe von Forschungslabors CAR-T-Zellen herstellen, sagte Dr. Nirali Shah vom NCI Center for Cancer Research , dem Co-Lead Investigator der CD33-CAR-T-Zell-Studie.
"Man kann nicht einfach Zellen in einem Labor herstellen und an Patienten weitergeben", sagte Dr. Shah, der im NIH Clinical Center in Bethesda, MD, mehrere Studien zu CAR-T-Zelltherapien bei Kindern mit Blutkrebs durchgeführt hat. "Man muss über die Infrastruktur, den Support und das Wissen verfügen, um dies gut zu können."
Mit einer bestehenden Einrichtung, dem Biopharmazeutischen Entwicklungsprogramm (BDP) am FNLCR in Frederick, MD, zur Herstellung biologischer Produkte, gab Dr. Welch die Möglichkeit für NCI, einen kritischen Bedarf zur Beschleunigung der CAR-T-Zell-Forschung zu decken .
"Das BDP hat Erfahrung in der Herstellung von Viren, Antikörpern , Proteinen und Impfstoffen , um frühe Studien zu unterstützen", fügte er hinzu. "Es hat Erfahrung mit hochwertigen Herstellungsprozessen."
Was das Programm jedoch nicht hatte, war Erfahrung in der Herstellung von CAR-T-Zellen.
Kooperationen, die für schnelle Maßnahmen von entscheidender Bedeutung sind
Mit der Zusage der NCI-Führung, die Fertigungsbemühungen zu unterstützen, bestand der nächste Schritt darin, den ersten zu unterstützenden Versuch zu identifizieren und den Fertigungsprozess festzulegen.
Einige der führenden Experten des Landes für die Entwicklung und Erprobung von CAR-T-Zelltherapien am NCI halfen beim ersten Schritt. Dr. Shah und ihre Kollegen in der Abteilung für pädiatrische Onkologie (POB) von NCI arbeiteten bereits an einer CD33-CAR-T-Zelle, die sie in Richtung einer Studie für Kinder mit AML vorantreiben. Dieses spezielle CAR wurde ursprünglich von Dr. Terry Fry, ehemals POB, und jetzt an der School of Medicine der University of Colorado entwickelt.
"Als das CD33-Konzept zum ersten Mal entwickelt wurde, dachten wir alle, es würde sich um eine Phase-1-Studie mit einem Zentrum handeln, da wir zuvor nicht über die Infrastruktur verfügten, um eine multizentrische Studie zu planen", sagte Dr. Shah.
Aber die Gemeinschaft von Forschern wie Dr. Shah und Aplenc, deren Arbeit sich auf die Entwicklung und Erprobung von Behandlungen, einschließlich Stammzelltransplantationen, für Kinder mit Blutkrebs konzentriert, sei sehr kooperativ, sagte sie. Und als die NCI-Fertigungsinitiative online ging, fügte sie hinzu: "Es gab jetzt einen Mechanismus, um über eine multizentrische Studie nachzudenken."
Zu dieser Forschungsgemeinschaft gehören das Zentrum für internationale Blut- und Marktransplantationsforschung, das als Hauptsponsor der Studie an Bord kam, und das National Marrow Donor Program, das das gesamte Verhalten verwaltet (z. B. Überwachung und Koordination des Zellversands, Überwachung des Patienten) Sicherheit).
Als nächstes war es Zeit, den Herstellungsprozess festzunageln. Der Standort war bereits identifiziert worden: das BDP, das Medikamente und Therapien aus biologischen Quellen wie Bakterien und Proteinen für Forschungsstudien herstellt.
Das NCI-Team wandte sich dann an NIH, um Fertigungskompetenz zu erhalten. Zu den Experten, die sie konsultierten, gehörten Dr. David Stroncek und Dr. Steve Highfill vom NIH- Zentrum für Zellulartechnik , das über umfangreiche Erfahrung in der Entwicklung und Herstellung von Zelltherapien, einschließlich CAR-T-Zellen, für Forscher innerhalb des NIH verfügt.
"Ihr Fachwissen und ihre Erfahrung waren von unschätzbarem Wert", sagte Dr. Welch.
Mit diesen Anleitungen und Rückmeldungen ausgestattet, entschied sich das NCI-Team für die Verwendung eines relativ neuen, im Handel erhältlichen Systems zur Herstellung von CAR-T-Zellen.
Das System, Prodigy genannt, ist „geschlossen“, was bedeutet, dass es, sobald die vom Patienten gesammelten Zellen in das System eingebracht wurden, den Rest erledigt und innerhalb von 2 Wochen ein fertiges CAR-T-Zell-Produkt produziert, erklärte Jason Yovandich, Ph .D., Auch von DCTD.
Bis zu diesem Zeitpunkt haben die meisten Labors und die Unternehmen, die die beiden von der FDA zugelassenen CAR-T-Zelltherapien herstellen, „offene“ Systeme verwendet, die mehr manuelle Manipulationen erfordern, um ein Endprodukt herzustellen. Mit einem geschlossenen System sagte Dr. Yovandich: "Die einzige Variable, die berücksichtigt werden muss, sind die Patientenzellen, die hineingehen."
Derzeit verfügt NCI über zwei Prodigy-Systeme, von denen ein drittes hinzugefügt werden soll. Je nachdem, wie diese Initiative voranschreitet, könnten weitere hinzugefügt werden, sagte er.
Ein anderes Modell
Am CHOP wurden zahlreiche klinische Studien zu CAR-T-Zelltherapien durchgeführt. Dr. Aplenc sagte, dass es nicht unerwartet Unterschiede bei der Durchführung eines Versuchs gibt, wenn die Behandlung nicht im eigenen Haus hergestellt wird. Für eine multizentrische Studie scheint jedoch ein einziger Hersteller die ideale Wahl zu sein.
"Wenn NCI die Zellherstellung nicht durchführen würde, wäre es äußerst schwierig, diese [multizentrische Studie] durchzuführen", sagte er.
Dr. Aplenc sagte, er erwarte keine Probleme mit der Herstellung der CD33 CAR T-Zellen an einem einzigen Ort. Selbst wenn eine CAR-T-Zelltherapie in einer einzigen Einrichtung im eigenen Haus hergestellt wird, muss immer eine Logistik durchgeführt werden. Zum Beispiel wird die Fertigungszeit "von der aktuellen Warteschlange in diesem Zentrum bestimmt, die vom Patientenvolumen und dem Fertigungsdurchsatz bestimmt werden kann", sagte er.
Und selbst wenn die Herstellung von CAR-T-Zelltherapien automatisiert wird, was voraussichtlich die Anzahl der Labore erhöhen wird, die an der Forschung mit diesen Therapien beteiligt sind, kann ein zentraler Ansatz eine wichtige Rolle bei klinischen Studien neuer Behandlungen am Menschen spielen, Dr. Shah notiert. "Ich denke, ein Modell wie dieses ist so vielversprechend", sagte sie.
Dr. Welch betonte, dass die Fertigungsinitiative noch in den Anfängen steckt und dass es einige Zeit dauern wird, bis sich herausstellt, wie sie sich entwickelt. "Wir machen immer noch kleine Schritte", sagte er.
Trotzdem ist viel Arbeit und Zusammenarbeit erforderlich, um so weit zu kommen. "Das ist es, was es braucht, um so etwas zusammenzustellen", sagte er. Die Zusammenarbeit "war enorm und entscheidend für die Fortschritte, die wir gemacht haben."
Quelle: National Cancer Institute